সোডিয়াম ডাইক্রোমেট
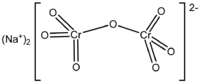
সোডিয়াম ডাইক্রোমেট একটি অজৈব যৌগ যার রাসায়নিক সংকেত Na2Cr2O7 । সাধারণত এই লবণটিতে দুই অণু কেলাস-জল থাকে। তাই সোডিয়াম ডাইক্রোমেট লবণের সংকেত Na2Cr2O7·2H2O এই ভাবে লেখা হয়। কার্যত সমস্ত ক্রোমিয়াম আকরিক থেকে প্রথমে সোডিয়াম ডাইক্রোমেট লবণ তৈরি করা হয়। পরে এই লবণ থেকে ক্রোমিয়ামের সব যৌগ এবং ক্রোমিয়ামঘটিত পদার্থ প্রস্তুত করা হয়।[১] সোডিয়াম ডাইক্রোমেট এবং পটাশিয়াম ডাইক্রোমেট দেখতে প্রায় একই রকম। এমনকি এদের মধ্যে বিক্রিয়াশীলতায় খুব মিল দেখা যায়। তবে পটাশিয়াম লবণের চেয়ে সোডিয়াম লবণ জলে প্রায় কুড়ি গুণ বেশি দ্রবণীয় এবং সোডিয়াম ডাইক্রোমেটের তুল্যাঙ্ক ভারও কম।[২]
| |

| |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
Sodium dichromate
| |
| অন্যান্য নাম
Chromic acid disodium salt
| |
| শনাক্তকারী | |
| |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| সিএইচইবিআই | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০৩১.০৭০ |
| ইসি-নম্বর |
|
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই | |
| ইউএন নম্বর | 3288 |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| Na2Cr2O7 | |
| আণবিক ভর | 261.97 g/mol (anhydrous) 298.00 g/mol (dihydrate) |
| বর্ণ | bright orange |
| গন্ধ | odorless |
| ঘনত্ব | 2.52 g/cm3 |
| গলনাঙ্ক | ৩৫৬.৭ °সে (৬৭৪.১ °ফা; ৬২৯.৮ K) |
| স্ফুটনাঙ্ক | ৪০০ °সে (৭৫২ °ফা; ৬৭৩ K) decomposes |
| 73 g/100 mL at 25 °C | |
| দ্রাব্যতা in other solvents | soluble in methanol, ethanol |
| প্রতিসরাঙ্ক (nD) | 1.661 (dihydrate) |
| ঝুঁকি প্রবণতা | |
| নিরাপত্তা তথ্য শীট | ICSC 1369 |
ইইউ শ্রেণীবিভাগ (ডিএসডি)
|
Oxidant (O) Carc. Cat. 2 Muta. Cat. 2 Repr. Cat. 2 Very toxic (T+) Harmful (Xn) Corrosive (C) Dangerous for the environment (N) |
| আর-বাক্যাংশ | আর৪৫, আর৪৬, আর৬০, আর৬১, আর৮, আর২১, আর২৫, আর২৬, আর৩৪, আর৪২/৪৩, আর৪৮/২৩, আর৫০/৫৩, |
| এস-বাক্যাংশ | এস৫৩, এস৪৫, এস৬০, এস৬১ |
| এনএফপিএ ৭০৪ | |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ)
|
50 mg/kg |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
Sodium chromate Sodium molybdate Sodium tungstate |
অন্যান্য ক্যাটায়নসমূহ
|
Potassium dichromate Ammonium dichromate |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
উৎপাদন
সম্পাদনাক্রোমিয়াম (III) অক্সাইডযুক্ত আকরিকগুলি থেকে বাণিজ্যিকভাবে সোডিয়াম ডাইক্রোমেট প্রস্তুত করা হয়। প্রথমে ক্রোমিয়াম আকরিকে বাতাসের উপস্থিতিতে প্রায় ১০০০ ডিগ্রি সেন্টিগ্রেড তাপমাত্রায় ক্ষারের সঙ্গে গলানো হয়। ক্ষার হিসাবে সাধারণত সোডিয়াম কার্বনেট ব্যবহার করা হয়:
2Cr2O3 + 4Na2CO3 + 3O2 -> 4Na2CrO4 + 4CO2
এর ফলে ক্রোমিয়াম দ্রবীভূত হয়ে সোডিয়াম ক্রোমেটের লবণ তৈরি হয় এবং এটিকে গরম জলের সাহায্যে দ্রবীভূত করে সোডিয়াম ক্রোমেটের দ্রবণ হিসাবে আলাদা করা হয়। এই পর্যায়ে, আকরিকের অন্যান্য উপাদান যেমন অ্যালুমিনিয়াম এবং আয়রনের যৌগগুলি খুব কম দ্রবণীয় হওয়ায় এগুলি অবশেষ হিসাবে থেকে যায়। সোডিয়াম ক্রোমেটের দ্রবণে সালফিউরিক অ্যাসিড যোগ করলে বা কার্বন ডাই অক্সাইড পরিচালিত করলে সোডিয়াম ডাইক্রোমেট তৈরি হয়:
2Na2CrO4 + 2CO2 + H2O -> Na2Cr2O7 + 2NaHCO3
2Na2CrO4 + H2SO4 -> Na2Cr2O7 + Na2SO4 + H2O
সোডিয়াম ডাইক্রোমেট কেলাস হিসাবে আলাদা করা হয়। এইভাবে, বার্ষিক কয়েক লক্ষ টন সোডিয়াম ডাইক্রোমেট উৎপন্ন করা হয়।
রাসায়নিক বিক্রিয়া
সম্পাদনাডাইক্রোমেট এবং ক্রোমেট লবণ জারক পদার্থ। চামড়ার ট্যানিংয়ের জন্য, প্রথমে সালফার ডাই অক্সাইড দিয়ে সোডিয়াম ডাইক্রোমেটকে বিজারিত করা হয়।
জৈব সংশ্লেষণের ক্ষেত্রে, এই যৌগট বেনজাইলিক এবং অ্যালইলিক যৌগের কার্বন-হাইড্রোজেন বন্ধনকে জারিত করে কার্বনিল অনুষঙ্গ যৌগ তৈরি করে।[২] উদাহরণস্বরূপ, ২,৪,৬-ট্রাইনাইট্রটলুইন জারিত হয়ে সংশ্লিষ্ট কার্বোঅক্সিলিক অ্যাসিড তৈরি হয়।[৩] একইভাবে ২,৩-ডাইমিথাইলন্যাপথালিন সোডিয়াম ডাইক্রোমেট দ্বারা জারিত হয়ে ২,৩-ন্যাপথালিনডাইকার্বোঅক্সিলিক তৈরি হয়।[৪]
সোডিয়াম ডাইক্রোমেট দ্বারা জারিত হয়ে সেকেণ্ডারী অ্যালকোহল সংশ্লিষ্ট কিটোনে পরিণত হয় যেমন, মেনথল থেকে মেনথোন,[৫] ডাইহাইড্রকোলেস্টেরল থেকে কোলেস্টেরন।[৬]
3 R2CHOH + Cr2O72− + 2 H+ → 3 R2C=O + Cr2O3 + 4 H2O
পটাশিয়াম লবণের থেকে সোডিয়াম ডাইক্রোমেটের প্রধান সুবিধা হলো এটি জলে এবং অ্যাসিটিক অ্যাসিডের মতো ধ্রুবী দ্রাবকে বেশি দ্রবণীয়।
সুরক্ষা
সম্পাদনাসমস্ত ষড়যোজী ক্রোমিয়াম যৌগের মতো, সোডিয়াম ডাইক্রোমেট ক্যান্সার সৃষ্টিকারী পদার্থ।[৭]
তথ্যসূত্র
সম্পাদনা- ↑ Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. ডিওআই:10.1002/14356007.a07_067
- ↑ ক খ Freeman, F. "Sodium Dichromate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. ডিওআই:10.1002/047084289X.
- ↑ Clarke, H. T.; Hartman, W. W. (1941). "2,4,6-Trinitrobenzoic Acid". Organic Syntheses.; Collective Volume, 1, p. 543
- ↑ Friedman, L. (1973). "2,3-Naphthalenedicarboxylic Acid". Organic Syntheses.; Collective Volume, 5, p. 810
- ↑ L. T. Sandborn (1929). "l-Menthone". Organic Syntheses. 9: 59.; Collective Volume, 1, p. 340
- ↑ W. F. Bruce (1941). "Cholestanone". Organic Syntheses.; Collective Volume, 2, p. 139
- ↑ IARC (২০১২) [17-24 March 2009]। Volume 100C: Arsenic, Metals, Fibres, and Dusts (পিডিএফ)। Lyon: International Agency for Research on Cancer। আইএসবিএন 978-92-832-0135-9। ১৭ মার্চ ২০২০ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ২০২০-০১-০৫।
There is sufficient evidence in humans for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds cause cancer of the lung. Also positive associations have been observed between exposure to Chromium (VI) compounds and cancer of the nose and nasal sinuses. There is sufficient evidence in experimental animals for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds are carcinogenic to humans (Group 1).
