সোডিয়াম কার্বনেট
এই নিবন্ধটি ইংরেজি থেকে আনাড়িভাবে অনুবাদ করা হয়েছে। এটি কোনও কম্পিউটার কর্তৃক অথবা দ্বিভাষিক দক্ষতাহীন কোনো অনুবাদক কর্তৃক অনূদিত হয়ে থাকতে পারে। |
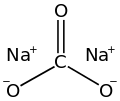
সোডিয়াম কার্বনেট (বেকিং সোডা, সোডা অ্যাশ এবং সোডা স্ফটিক নামেও পরিচিত) হল Na2CO3 এবং এর বিভিন্ন হাইড্রেটের সূত্র সহ অজৈব যৌগ। সোডিয়াম কার্বনেটের সব রূপই সাদা বর্ণের। ভৌত ধর্মের দিক থেকে এটি গন্ধহীন এবং জলে দ্রাব্য। জলে দ্রবীভূত হয়ে এটি ক্ষারীয় দ্রবণ তৈরি করে।
| |

| |
| নামসমূহ | |
|---|---|
| ইউপ্যাক নাম
সোডিয়াম কার্বনেট
| |
| পছন্দসই ইউপ্যাক নাম
Disodium carbonate | |
| অন্যান্য নাম
Soda ash, washing soda, soda crystals, sodium trioxocarbonate
| |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০০৭.১২৭ |
| ইসি-নম্বর |
|
| ই নম্বর | E৫০০(i) (অম্লতা নিয়ন্ত্রক, ...) |
পাবকেম CID
|
|
| আরটিইসিএস নম্বর |
|
| ইউএনআইআই |
|
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| Na2CO3 | |
| আণবিক ভর | 105.9888 g/mol (anhydrous) 286.1416 g/mol (decahydrate) |
| বর্ণ | White solid, hygroscopic |
| গন্ধ | Odorless |
| ঘনত্ব | |
| গলনাঙ্ক | ৮৫১ °সে (১,৫৬৪ °ফা; ১,১২৪ K) (Anhydrous) ১০০ °সে (২১২ °ফা; ৩৭৩ K) decomposes (monohydrate) ৩৩.৫ °সে (৯২.৩ °ফা; ৩০৬.৬ K) decomposes (heptahydrate) ৩৪ °সে (৯৩ °ফা; ৩০৭ K) (decahydrate)[২][৭] |
Anhydrous, g/100 mL:
| |
| দ্রাব্যতা | Soluble in aq. alkalis,[৩] glycerol Slightly soluble in aq. alcohol Insoluble in CS2, acetone, alkyl acetates, alcohol, benzonitrile, liquid ammonia[৪] |
| দ্রাব্যতা in glycerine | 98.3 g/100 g (155 °C)[৪] |
| দ্রাব্যতা in ethanediol | 3.46 g/100 g (20 °C)[৫] |
| দ্রাব্যতা in dimethylformamide | 0.5 g/kg[৫] |
| অম্লতা (pKa) | 10.33 [৬] |
| −4.1·10−5 cm3/mol[২] | |
| প্রতিসরাঙ্ক (nD) | 1.485 (anhydrous) 1.420 (monohydrate)[৭] 1.405 (decahydrate) |
| সান্দ্রতা | 3.4 cP (887 °C)[৫] |
| গঠন | |
| স্ফটিক গঠন | Monoclinic (γ-form, β-form, δ-form, anhydrous)[৮] Orthorhombic (monohydrate, heptahydrate)[১][৯] |
| Space group | C2/m, No. 12 (γ-form, anhydrous, 170 K) C2/m, No. 12 (β-form, anhydrous, 628 K) P21/n, No. 14 (δ-form, anhydrous, 110 K)[৮] Pca21, No. 29 (monohydrate)[১] Pbca, No. 61 (heptahydrate)[৯] |
| Point group | 2/m (γ-form, β-form, δ-form, anhydrous)[৮] mm2 (monohydrate)[১] 2/m 2/m 2/m (heptahydrate)[৯] |
| Lattice constant | |
| Coordination geometry |
Octahedral (Na+, anhydrous) |
| তাপ রসায়নবিদ্যা | |
| তাপ ধারকত্ব, C | 112.3 J/mol·K[২] |
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
135 J/mol·K[২] |
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−1130.7 kJ/mol[২][৫] |
গিবসের মুক্ত শক্তি (ΔfG˚)
|
−1044.4 kJ/mol[২] |
| ঝুঁকি প্রবণতা | |
| প্রধান ঝুঁকিসমূহ | Irritant |
| নিরাপত্তা তথ্য শীট | MSDS |
| জিএইচএস চিত্রলিপি |  [১০] [১০]
|
| জিএইচএস সাংকেতিক শব্দ | সতর্কতা |
| জিএইচএস বিপত্তি বিবৃতি | H319[১০] |
| জিএইচএস সতর্কতামূলক বিবৃতি | P305+351+338[১০] |
| এনএফপিএ ৭০৪ | |
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |
LD৫০ (মধ্যমা ডোজ)
|
4090 mg/kg (rat, oral)[১১] |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
Sodium bicarbonate |
অন্যান্য ক্যাটায়নসমূহ
|
Lithium carbonate Potassium carbonate Rubidium carbonate Cesium carbonate |
সম্পর্কিত যৌগ
|
Sodium sesquicarbonate Sodium percarbonate |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
সোডিয়াম কার্বোনেট সর্বপ্রথম সোডিয়াম সমৃদ্ধ মাটিতে জন্মানো উদ্ভিদের ছাই থেকে বের করা হয়েছিল। কারণ এই সোডিয়াম-সমৃদ্ধ উদ্ভিদের ছাই কাঠের ছাই থেকে লক্ষণীয়ভাবে আলাদা ছিল (একসময় পটাশ উৎপাদনের জন্য ব্যবহৃত হত), সোডিয়াম কার্বনেট "সোডা অ্যাশ" নামে পরিচিত হয়ে ওঠে। [সম্পূর্ণ উদ্ধৃতি প্রয়োজন] এটি সোডিয়াম ক্লোরাইড এবং চুনাপাথর থেকে সোলভে প্রক্রিয়ার মাধ্যমে প্রচুর পরিমাণে উত্পাদিত হয়, সেইসাথে কার্বনেট সোডিয়াম হাইড্রক্সাইড যা ক্লোর-ক্ষার প্রক্রিয়া ব্যবহার করে তৈরি করা হয়।
হাইড্রেটস
সম্পাদনাসোডিয়াম কার্বনেট তিনটি হাইড্রেট হিসাবে এবং নির্জল লবণ হিসাবে প্রাপ্ত হয়:
- সোডিয়াম কার্বনেট ডেকাহাইড্রেট (ন্যাট্রন), Na2CO3·10H2O, যা সহজেই মনোহাইড্রেট গঠনের জন্য প্রস্ফুটিত হয়।
- সোডিয়াম কার্বনেট হেপ্টাহাইড্রেট (খনিজ আকারে পরিচিত নয়), Na2CO3·7H2O।
- সোডিয়াম কার্বনেট মনোহাইড্রেট (থার্মোনাট্রাইট), Na2CO3·H2O। ক্রিস্টাল কার্বনেট নামেও পরিচিত।
- অ্যানহাইড্রাস সোডিয়াম কার্বনেট (ন্যাট্রাইট), যা ক্যালসাইন্ড সোডা নামেও পরিচিত, হাইড্রেটগুলিকে গরম করে গঠিত হয়। সোডিয়াম হাইড্রোজেনকার্বোনেট উত্তপ্ত হলে (ক্যালসাইন করা) যেমন এটি গঠিত হয় Solvay proc এর চূড়ান্ত ধাপে
ডিকাহাইড্রেট তৈরি হয় পানির দ্রবণ থেকে −2.1 থেকে +32.0 °C তাপমাত্রার পরিসরে স্ফটিক করে, হেপ্টাহাইড্রেট 32.0 থেকে 35.4 °C এবং এই তাপমাত্রার উপরে মনোহাইড্রেট তৈরি হয়। শুষ্ক বাতাসে ডিকাহাইড্রেট এবং হেপ্টাহাইড্রেট মনোহাইড্রেট দেওয়ার জন্য জল হারায়। অন্যান্য হাইড্রেট রিপোর্ট করা হয়েছে, যেমন সোডিয়াম কার্বনেট ইউনিট প্রতি 2.5 ইউনিট জল সহ ("পেন্টাহেমিহাইড্রেট")।
পরিষ্কার করার সোডা
সম্পাদনাসোডিয়াম কার্বনেট ডেকাহাইড্রেট (Na2CO3·10H2O), যা ওয়াশিং সোডা নামেও পরিচিত, হল সোডিয়াম কার্বনেটের সবচেয়ে সাধারণ হাইড্রেট যাতে ১০টি পানির স্ফটিকের অণু থাকে। সোডা অ্যাশ জলে দ্রবীভূত হয় এবং ওয়াশিং সোডা পেতে স্ফটিক করা হয়। এটি কয়েকটি ধাতব কার্বনেটের মধ্যে একটি যা পানিতে দ্রবণীয়।
প্রয়োগ
সম্পাদনাসোডিয়াম কার্বনেটের কিছু সাধারণ প্রয়োগের মধ্যে রয়েছে:
- কাপড় ধোয়ার মতো ঘরোয়া কাজে ক্লিনজিং এজেন্ট হিসেবে। সোডিয়াম কার্বনেট অনেক শুকনো সাবান পাউডারের একটি উপাদান। স্যাপোনিফিকেশন প্রক্রিয়ার মাধ্যমে এটির ডিটারজেন্ট বৈশিষ্ট্য রয়েছে, যা চর্বি এবং গ্রীসকে জলে দ্রবণীয় লবণে (আসলে সাবান) রূপান্তরিত করে।
- এটি পানির কঠোরতা কমানোর জন্য ব্যবহৃত হয় (§ জল নরম করা)।
- এটি কাচ, সাবান এবং কাগজ তৈরিতে ব্যবহৃত হয় (§ গ্লাস তৈরি দেখুন)।
- এটি বোরাক্সের মতো সোডিয়াম যৌগ তৈরিতে ব্যবহৃত হয়।
সোডিয়াম কার্বনেট সিলিকার জন্য একটি প্রবাহ হিসাবে কাজ করে (SiO2, গলনাঙ্ক 1,713 °C),
মিশ্রণের গলনাঙ্ককে বিশেষ উপকরণ ছাড়াই অর্জনযোগ্য কিছুতে কমিয়ে দেয়। এই "সোডা গ্লাস" মৃদুভাবে জলে দ্রবণীয়, তাই কিছু ক্যালসিয়াম কার্বনেট গলিত মিশ্রণে যোগ করা হয় যাতে কাচকে অদ্রবণীয় করে। বোতল এবং জানালার গ্লাস ("সোডা-লাইম গ্লাস" ট্রানজিস্টন তাপমাত্রা ~570 °C) সোডিয়াম কার্বনেট, ক্যালসিয়াম কার্বনেট এবং সিলিকা বালি (সিলিকন ডাই অক্সাইড (SiO2)) এর মিশ্রণগুলিকে গলিয়ে তৈরি করা হয়। যখন এই উপাদানগুলি উত্তপ্ত হয়, কার্বনেটগুলি কার্বন ডাই অক্সাইড ছেড়ে দেয়। এইভাবে, সোডিয়াম কার্বনেট সোডিয়াম অক্সাইডের উৎস। সোডা-লাইম গ্লাস বহু শতাব্দী ধরে কাচের সবচেয়ে সাধারণ রূপ। এটি টেবিলওয়্যার গ্লাস উত্পাদন জন্য একটি মূল ইনপুট
জল নরম করা
সম্পাদনাশক্ত পানিতে সাধারণত ক্যালসিয়াম বা ম্যাগনেসিয়াম আয়ন থাকে। সোডিয়াম কার্বনেট এই আয়নগুলি অপসারণ এবং সোডিয়াম আয়নগুলির সাথে প্রতিস্থাপনের জন্য ব্যবহৃত হয়।[১৩]
জল নরম হয় কারণ এতে আর দ্রবীভূত ক্যালসিয়াম আয়ন এবং ম্যাগনেসিয়াম আয়ন থাকে না।[১৩]
খাদ্যে সংযোজন এবং রান্না
সম্পাদনারান্নায় সোডিয়াম কার্বোনেটের বেশ কিছু ব্যবহার রয়েছে, মূলত কারণ এটি বেকিং সোডা (সোডিয়াম বাইকার্বোনেট) থেকে শক্তিশালী ভিত্তি কিন্তু লাইয়ের চেয়ে দুর্বল (যা সোডিয়াম হাইড্রোক্সাইড বা কম সাধারণভাবে পটাশিয়াম হাইড্রক্সাইডকে বোঝায়)। ক্ষারত্ব মাখানো ময়দার মধ্যে গ্লুটেন উৎপাদনকে প্রভাবিত করে এবং যে তাপমাত্রায় Maillard প্রতিক্রিয়া ঘটে তা কমিয়ে বাদামী রঙের উন্নতি করে। পূর্বের প্রভাবের সুবিধা নিতে, সোডিয়াম কার্বনেট তাই কানসুই (かん水) এর উপাদানগুলির মধ্যে একটি, ক্ষারীয় লবণের একটি দ্রবণ যা জাপানি রামেন নুডলসকে তাদের বৈশিষ্ট্যযুক্ত গন্ধ এবং চিবানো টেক্সচার দিতে ব্যবহৃত হয়; একই কারণে একই ধরনের দ্রবণ চীনা রন্ধনপ্রণালীতে লামিয়ান তৈরি করতে ব্যবহৃত হয়। ক্যান্টোনিজ বেকাররা একইভাবে লাই-ওয়াটারের বিকল্প হিসেবে সোডিয়াম কার্বনেট ব্যবহার করে যাতে চাঁদের কেককে তাদের বৈশিষ্ট্যপূর্ণ গঠন এবং বাদামী রং উন্নত করা যায়। জার্মান রন্ধনশৈলীতে (এবং সেন্ট্রাল ইউরোপীয় রন্ধনপ্রণালী আরও বিস্তৃতভাবে), ব্রেড যেমন প্রিটজেল এবং লাই রোলগুলিকে ঐতিহ্যগতভাবে লাই দিয়ে চিকিত্সা করা হয় ব্রাউনিং উন্নত করার পরিবর্তে সোডিয়াম কার্বনেট দিয়ে চিকিত্সা করা যেতে পারে; সোডিয়াম কার্বনেট লাইয়ের মতো শক্তিশালী ব্রাউনিং তৈরি করে না, তবে এটির সাথে কাজ করা অনেক বেশি নিরাপদ এবং সহজ।
শরবতের গুঁড়া উৎপাদনে সোডিয়াম কার্বনেট ব্যবহার করা হয়। সোডিয়াম কার্বনেট এবং একটি দুর্বল অ্যাসিড, সাধারণত সাইট্রিক অ্যাসিড, কার্বন ডাই অক্সাইড গ্যাস নির্গত করে, যেটি লালা দ্বারা শরবতকে আর্দ্র করার সময় ঘটে থাকে।
সোডিয়াম কার্বোনেট খাদ্য শিল্পে খাদ্য সংযোজনকারী (E500) হিসাবে একটি অ্যাসিডিটি নিয়ন্ত্রক, অ্যান্টিকেকিং এজেন্ট, রেইজিং এজেন্ট এবং স্টেবিলাইজার হিসাবে ব্যবহার করে। এটি চূড়ান্ত পণ্যের pH স্থিতিশীল করতে স্নাস উত্পাদনেও ব্যবহৃত হয়।
যদিও এটি লাইয়ের তুলনায় রাসায়নিক পোড়া হওয়ার সম্ভাবনা কম, তবুও রান্নাঘরে সোডিয়াম কার্বনেটের সাথে কাজ করার সময় যত্ন নেওয়া উচিত, কারণ এটি অ্যালুমিনিয়াম রান্নার পাত্র, পাত্র এবং ফয়েলের জন্য ক্ষয়কারী।
অন্যান্য প্রয়োগ
সম্পাদনাসোডিয়াম কার্বনেট বিভিন্ন ক্ষেত্রে তুলনামূলকভাবে শক্তিশালী ভিত্তি হিসাবেও ব্যবহৃত হয়। একটি সাধারণ ক্ষার হিসাবে, এটি অনেক রাসায়নিক প্রক্রিয়ায় পছন্দ করা হয় কারণ এটি সোডিয়াম হাইড্রক্সাইডের চেয়ে সস্তা এবং পরিচালনা করা অনেক বেশি নিরাপদ। এর মৃদুতা বিশেষ করে গার্হস্থ্য অ্যাপ্লিকেশনে এর ব্যবহারের সুপারিশ করে।
উদাহরণস্বরূপ, বেশিরভাগ ফটোগ্রাফিক ফিল্ম ডেভেলপিং এজেন্টদের কর্মের জন্য প্রয়োজনীয় স্থিতিশীল ক্ষারীয় অবস্থা বজায় রাখার জন্য এটি একটি pH নিয়ন্ত্রক হিসাবে ব্যবহৃত হয়। এটি একটি পছন্দসই pH এবং কার্বনেট কঠোরতা (KH) বজায় রাখার জন্য সুইমিং পুল এবং অ্যাকোয়ারিয়ামের জলে একটি সাধারণ সংযোজন। ফাইবার-প্রতিক্রিয়াশীল রঞ্জকগুলির সাথে রঞ্জনকালে, সোডিয়াম কার্বনেট (প্রায়শই সোডা অ্যাশ ফিক্সেটিভ বা সোডা অ্যাশ অ্যাক্টিভেটর নামে একটি নামে) সেলুলোজ (উদ্ভিদ) ফাইবারগুলির সাথে রঞ্জকের সঠিক রাসায়নিক বন্ধন নিশ্চিত করতে ব্যবহৃত হয়, সাধারণত রঞ্জন করার আগে (টাই ডাইয়ের জন্য) , রঞ্জক সঙ্গে মিশ্রিত (ডাই পেইন্টিং জন্য), বা রঞ্জনবিদ্যা পরে (নিমজ্জন রঞ্জনবিদ্যা জন্য)। এটি CaO এবং অন্যান্য হালকা মৌলিক যৌগগুলির পাশাপাশি একটি ফ্লোট কন্ডিশনার হিসাবে একটি অনুকূল pH বজায় রাখতে ফ্রোথ ফ্লোটেশন প্রক্রিয়াতেও ব্যবহৃত হয়।
সোডিয়াম বাইকার্বোনেট (NaHCO3) বা বেকিং সোডা, এছাড়াও অগ্নি নির্বাপক একটি উপাদান, প্রায়ই সোডিয়াম কার্বনেট থেকে উত্পন্ন হয়। যদিও NaHCO3 নিজেই সলভে প্রক্রিয়ার একটি মধ্যবর্তী পণ্য, তবে এটিকে দূষিত করে এমন অ্যামোনিয়া অপসারণের জন্য প্রয়োজনীয় গরম করার ফলে কিছু NaHCO3 পচে যায়, যা CO2-এর সাথে সমাপ্ত Na2CO33-এর প্রতিক্রিয়া আরও লাভজনক করে তোলে:
একটি সম্পর্কিত প্রতিক্রিয়ায়, সোডিয়াম কার্বোনেট সোডিয়াম বিসালফাইট (NaHSO3) তৈরি করতে ব্যবহৃত হয়, যা সেলুলোজ থেকে লিগনিনকে আলাদা করার "সালফাইট" পদ্ধতিতে ব্যবহৃত হয়। এই প্রতিক্রিয়াটি পাওয়ার স্টেশনগুলিতে ফ্লু গ্যাস থেকে সালফার ডাই অক্সাইড অপসারণের জন্য শোষিত হয়:
এই অ্যাপ্লিকেশনটি আরও সাধারণ হয়ে উঠেছে, বিশেষ করে যেখানে স্টেশনগুলিকে কঠোর নির্গমন নিয়ন্ত্রণগুলি পূরণ করতে হয়৷
সোডিয়াম কার্বনেট তুলা শিল্প দ্বারা অস্পষ্ট তুলাবীজের অ্যাসিড ডিলিন্টিংয়ের জন্য প্রয়োজনীয় সালফিউরিক অ্যাসিডকে নিরপেক্ষ করতে ব্যবহৃত হয়।।
এটি আয়ন বিনিময়ের মাধ্যমে অন্যান্য ধাতুর কার্বনেট তৈরি করতেও ব্যবহৃত হয়, প্রায়শই অন্যান্য ধাতুর সালফেটের সাথে।
বিবিধ
সম্পাদনাসোডিয়াম কার্বনেট কাদামাটি বের করার জন্য প্রয়োজনীয় জলের পরিমাণ কমাতে একটি ভেজানো এজেন্ট হিসাবে ইট শিল্প ব্যবহার করে। ঢালাইয়ে, এটি "বন্ডিং এজেন্ট" হিসাবে উল্লেখ করা হয় এবং ভেজা অ্যালজিনেটকে জেলযুক্ত অ্যালজিনেটের সাথে লেগে থাকতে দেওয়ার জন্য ব্যবহার করা হয়। সোডিয়াম কার্বনেট টুথপেস্টে ব্যবহার করা হয়, যেখানে এটি ফোমিং এজেন্ট এবং ঘষিয়া তুলিয়া ফেলিতে সক্ষম এবং সাময়িকভাবে মুখের pH বাড়াতে কাজ করে।
সোডিয়াম কার্বোনেট পশুর চামড়া প্রক্রিয়াকরণ এবং ট্যানিংয়েও ব্যবহৃত হয়।[তথ্যসূত্র প্রয়োজন]
শারীরিক বৈশিষ্ট্য
সম্পাদনা10% w/w জলীয় দ্রবণের জন্য সোডিয়াম কার্বনেটের দ্রবণের অবিচ্ছেদ্য এনথালপি হল −28.1 kJ/mol। সোডিয়াম কার্বনেট মনোহাইড্রেটের মোহস কঠোরতা 1.3।
প্রাকৃতিক খনিজ হিসাবে ঘটনা
সম্পাদনাসোডিয়াম কার্বনেট পানিতে দ্রবণীয়, এবং শুষ্ক অঞ্চলে প্রাকৃতিকভাবে ঘটতে পারে, বিশেষ করে মৌসুমী হ্রদ বাষ্পীভূত হওয়ার সময় খনিজ জমা (বাষ্পীভবন) তৈরি হয়। প্রাচীনকাল থেকে মিশরের শুষ্ক হ্রদের তলদেশ থেকে খনিজ ন্যাট্রনের আমানত খনন করা হয়েছে, যখন ন্যাট্রন মমি তৈরিতে এবং কাচের প্রাথমিক উত্পাদনে ব্যবহৃত হত।।
সোডিয়াম কার্বনেটের অ্যানহাইড্রাস খনিজ রূপটি বেশ বিরল এবং একে নাট্রাইট বলা হয়। সোডিয়াম কার্বনেট তানজানিয়ার অনন্য আগ্নেয়গিরি ওল ডোইনিও লেংগাই থেকেও অগ্ন্যুৎপাত হয় এবং এটি অতীতে অন্যান্য আগ্নেয়গিরি থেকে অগ্ন্যুৎপাত হয়েছিল বলে ধারণা করা হয়, কিন্তু পৃথিবীর পৃষ্ঠে এই খনিজগুলির অস্থিরতার কারণে ক্ষয় হওয়ার সম্ভাবনা রয়েছে। সোডিয়াম কার্বোনেটের তিনটি খনিজ রূপ, সেইসাথে ট্রোনা, ট্রাইসোডিয়াম হাইড্রোজেনডিকার্বনেট ডাইহাইড্রেট, অতি-ক্ষারীয় পেগম্যাটিটিক শিলা থেকেও পরিচিত, যেগুলি রাশিয়ার কোলা উপদ্বীপে ঘটে।
বহিরাগতভাবে, পরিচিত সোডিয়াম কার্বনেট বিরল। আমানতকে সেরেসের উজ্জ্বল দাগের উৎস হিসেবে চিহ্নিত করা হয়েছে, অভ্যন্তরীণ উপাদান যা পৃষ্ঠে আনা হয়েছে। যদিও মঙ্গলে কার্বনেট রয়েছে এবং এর মধ্যে সোডিয়াম কার্বনেট অন্তর্ভুক্ত থাকবে বলে আশা করা হচ্ছে, আমানতগুলি এখনও নিশ্চিত করা যায়নি, এই অনুপস্থিতিকে পূর্বে জলীয় মঙ্গলের মাটিতে কম pH এর বৈশ্বিক আধিপত্যের কারণে ব্যাখ্যা করা হয়েছে।
উৎপাদন
সম্পাদনাখনির
সম্পাদনাট্রোনা, ট্রাইসোডিয়াম হাইড্রোজেনডিকার্বোনেট ডাইহাইড্রেট (Na3HCO3CO3·2H2O) নামেও পরিচিত, মার্কিন যুক্তরাষ্ট্রের বিভিন্ন এলাকায় খনন করা হয় এবং সোডিয়াম কার্বনেটের প্রায় সমস্ত মার্কিন খরচ সরবরাহ করে। ১৯৩৮ সালে পাওয়া বৃহৎ প্রাকৃতিক আমানত, যেমন গ্রিন রিভার, ওয়াইমিং এর কাছে, উত্তর আমেরিকায় শিল্প উৎপাদনের চেয়ে খনির কাজকে আরও বেশি লাভজনক করে তুলেছে। তুরস্কে ট্রোনার গুরুত্বপূর্ণ মজুদ রয়েছে; আঙ্কারার কাছে মজুদ থেকে দুই মিলিয়ন টন সোডা অ্যাশ বের করা হয়েছে।
ড্রেজিংয়ের মাধ্যমে কেনিয়ার মাগাদি হ্রদের মতো কিছু ক্ষারীয় হ্রদ থেকেও এটি খনন করা হয়। গরম স্যালাইন স্প্রিংস ক্রমাগত হ্রদে লবণ পুনরায় পূরণ করে যাতে, যদি ড্রেজিংয়ের হার পুনরায় পূরণের হারের চেয়ে বেশি না হয় তবে উত্সটি সম্পূর্ণভাবে টেকসই হয়। [তথ্যসূত্র প্রয়োজন]
Barilla এবং kelp
সম্পাদনাবেশ কিছু "হ্যালোফাইট" (লবণ-সহনশীল) উদ্ভিদের প্রজাতি এবং সামুদ্রিক শৈবালের প্রজাতিকে প্রক্রিয়াজাত করা যেতে পারে যাতে সোডিয়াম কার্বনেটের একটি অপবিত্র রূপ পাওয়া যায় এবং এই উত্সগুলি 19 শতকের গোড়ার দিকে ইউরোপ এবং অন্য কোথাও প্রাধান্য পায়। জমির গাছপালা (সাধারণত গ্লাসওয়ার্টস বা সল্টওয়ার্ট) বা সামুদ্রিক শৈবাল (সাধারণত ফুকাস প্রজাতি) কাটা, শুকানো এবং পুড়িয়ে ফেলা হয়। ছাইকে তখন "লিক্সিভেটেড" (জল দিয়ে ধুয়ে) একটি ক্ষারীয় দ্রবণ তৈরি করা হয়। চূড়ান্ত পণ্য তৈরি করার জন্য এই দ্রবণটি শুকিয়ে সিদ্ধ করা হয়েছিল, যাকে "সোডা অ্যাশ" বলা হয়েছিল; এই খুব পুরানো নামটি আরবি শব্দ সোডা থেকে এসেছে, ফলস্বরূপ সালসোলা সোডাতে প্রয়োগ করা হয়েছে, যা উৎপাদনের জন্য সংগ্রহ করা সমুদ্রতীরবর্তী উদ্ভিদের অনেক প্রজাতির মধ্যে একটি। "বারিলা" হল একটি বাণিজ্যিক শব্দ যা উপকূলীয় গাছপালা বা কেল্প থেকে প্রাপ্ত পটাশের একটি অপবিত্র ফর্মে প্রয়োগ করা হয়।
সোডা অ্যাশ-এ সোডিয়াম কার্বনেটের ঘনত্ব ব্যাপকভাবে পরিবর্তিত হয়, সামুদ্রিক শৈবাল থেকে প্রাপ্ত আকারের ("কেল্প") জন্য 2-3 শতাংশ থেকে স্পেনের লবণাক্ত গাছ থেকে উৎপাদিত সেরা বারিলার জন্য 30 শতাংশ। সোডা অ্যাশের জন্য উদ্ভিদ এবং সামুদ্রিক শৈবালের উত্স, এবং এছাড়াও সম্পর্কিত ক্ষার "পটাশ" এর জন্য, 18 শতকের শেষের দিকে ক্রমবর্ধমানভাবে অপর্যাপ্ত হয়ে ওঠে এবং লবণ এবং অন্যান্য রাসায়নিক পদার্থ থেকে সোডা অ্যাশ সংশ্লেষণের জন্য বাণিজ্যিকভাবে কার্যকর পথের সন্ধান আরও তীব্র হয়।
লেব্লাঙ্ক প্রক্রিয়া
সম্পাদনা1792 সালে, ফরাসি রসায়নবিদ নিকোলাস লেব্লাঙ্ক লবণ, সালফিউরিক অ্যাসিড, চুনাপাথর এবং কয়লা থেকে সোডিয়াম কার্বনেট তৈরির জন্য একটি প্রক্রিয়া পেটেন্ট করেন। প্রথম ধাপে, ম্যানহাইম প্রক্রিয়ায় সোডিয়াম ক্লোরাইডকে সালফিউরিক অ্যাসিড দিয়ে চিকিত্সা করা হয়। এই প্রতিক্রিয়া সোডিয়াম সালফেট (লবণ কেক) এবং হাইড্রোজেন ক্লোরাইড তৈরি করে:
লবণের কেক এবং চূর্ণ চুনাপাথর (ক্যালসিয়াম কার্বনেট) কয়লা দিয়ে গরম করে হ্রাস করা হয়েছিল। এই রূপান্তর দুটি অংশ entails. প্রথমটি হল কার্বোথার্মিক বিক্রিয়া যেখানে কয়লা, কার্বনের উৎস, সালফেটকে সালফাইডে কমিয়ে দেয়:
দ্বিতীয় পর্যায় হল সোডিয়াম কার্বনেট এবং ক্যালসিয়াম সালফাইড তৈরির প্রতিক্রিয়া:
এই মিশ্রণকে কালো ছাই বলা হয়। কালো ছাই থেকে পানি দিয়ে সোডা অ্যাশ বের করা হয়। এই নির্যাসের বাষ্পীভবন থেকে কঠিন সোডিয়াম কার্বনেট পাওয়া যায়। এই নিষ্কাশন প্রক্রিয়া বলা হয় lixiviating.।
লেব্লাঙ্ক প্রক্রিয়া দ্বারা উত্পাদিত হাইড্রোক্লোরিক অ্যাসিড ছিল বায়ু দূষণের একটি প্রধান উৎস, এবং ক্যালসিয়াম সালফাইড উপজাত বর্জ্য নিষ্পত্তির সমস্যাও উপস্থাপন করে। যাইহোক, এটি 1880 এর দশকের শেষ পর্যন্ত সোডিয়াম কার্বনেটের জন্য প্রধান উৎপাদন পদ্ধতি ছিল।
সলভে প্রক্রিয়া
সম্পাদনা1861 সালে, বেলজিয়ামের শিল্প রসায়নবিদ আর্নেস্ট সলভে সোডিয়াম ক্লোরাইড, অ্যামোনিয়া, জল এবং কার্বন ডাই অক্সাইডকে সোডিয়াম বাইকার্বোনেট এবং অ্যামোনিয়াম ক্লোরাইড উৎপন্ন করার জন্য প্রথম বিক্রিয়া করে সোডিয়াম কার্বনেট তৈরি করার একটি পদ্ধতি তৈরি করেছিলেন: [১৪]
ফলে সোডিয়াম বাইকার্বোনেটকে গরম করে সোডিয়াম কার্বনেটে রূপান্তরিত করা হয়, জল এবং কার্বন ডাই অক্সাইড মুক্ত করে:
এদিকে, কার্বন ডাই অক্সাইড উৎপাদন থেকে অবশিষ্ট চুন (ক্যালসিয়াম অক্সাইড) দিয়ে চিকিত্সা করে অ্যামোনিয়াকে অ্যামোনিয়াম ক্লোরাইড উপজাত থেকে পুনরুত্পাদন করা হয়েছিল:
সলভে প্রক্রিয়া তার অ্যামোনিয়া পুনর্ব্যবহার করে। এটি শুধুমাত্র ব্রেন এবং চুনাপাথর গ্রহণ করে এবং ক্যালসিয়াম ক্লোরাইড হল এর একমাত্র বর্জ্য পণ্য। প্রক্রিয়াটি লেব্লাঙ্ক প্রক্রিয়ার তুলনায় যথেষ্ট পরিমাণে লাভজনক, যা দুটি বর্জ্য পণ্য, ক্যালসিয়াম সালফাইড এবং হাইড্রোজেন ক্লোরাইড তৈরি করে। সলভে প্রক্রিয়া দ্রুত বিশ্বব্যাপী সোডিয়াম কার্বনেট উৎপাদনে আধিপত্য বিস্তার করে। 1900 সাল নাগাদ, 90% সোডিয়াম কার্বনেট সলভে প্রক্রিয়া দ্বারা উত্পাদিত হয়েছিল, এবং শেষ লেব্লাঙ্ক প্রক্রিয়া প্ল্যান্টটি 1920 এর দশকের প্রথম দিকে বন্ধ হয়ে যায়।
Solvay প্রক্রিয়ার দ্বিতীয় ধাপ, সোডিয়াম বাইকার্বোনেট গরম করা, বাড়ির বাবুর্চিরা এবং রেস্তোরাঁয় রান্নার উদ্দেশ্যে (প্রেটজেল এবং ক্ষারীয় নুডলস সহ) সোডিয়াম কার্বনেট তৈরি করতে একটি ছোট পরিসরে ব্যবহার করে। পদ্ধতিটি এই ধরনের ব্যবহারকারীদের কাছে আকর্ষণীয় কারণ সোডিয়াম বাইকার্বোনেট ব্যাপকভাবে বেকিং সোডা হিসাবে বিক্রি হয় এবং বেকিং সোডাকে সোডিয়াম কার্বনেটে রূপান্তর করার জন্য প্রয়োজনীয় তাপমাত্রা (250 °F (121 °C) থেকে 300 °F (149 °C)) সহজেই পাওয়া যায়। প্রচলিত রান্নাঘরের চুলায়।
হাউ এর প্রক্রিয়া
সম্পাদনাএই প্রক্রিয়াটি ১৯৩০-এর দশকে চীনা রসায়নবিদ হাউ ডিবাং দ্বারা তৈরি করা হয়েছিল। পূর্বের বাষ্প সংস্কারের উপজাত কার্বন ডাই অক্সাইড সোডিয়াম ক্লোরাইড এবং অ্যামোনিয়ার একটি স্যাচুরেটেড দ্রবণের মাধ্যমে এই প্রতিক্রিয়াগুলির দ্বারা সোডিয়াম বাইকার্বনেট তৈরি করতে পাম্প করা হয়েছিল:
সোডিয়াম বাইকার্বোনেট কম দ্রবণীয়তার কারণে একটি অবক্ষেপ হিসাবে সংগ্রহ করা হয়েছিল এবং তারপরে প্রায় 80 °C (176 °F) বা 95 °C (203 °F) পর্যন্ত উত্তপ্ত করা হয়েছিল যাতে Solvay প্রক্রিয়ার শেষ ধাপের মতো বিশুদ্ধ সোডিয়াম কার্বনেট পাওয়া যায়। অ্যামোনিয়াম এবং সোডিয়াম ক্লোরাইডের অবশিষ্ট দ্রবণে আরও সোডিয়াম ক্লোরাইড যোগ করা হয়; এছাড়াও, এই দ্রবণে আরও অ্যামোনিয়া 30-40 °C তাপমাত্রায় পাম্প করা হয়। তারপর দ্রবণের তাপমাত্রা 10 ডিগ্রি সেলসিয়াসের নিচে নামিয়ে আনা হয়। অ্যামোনিয়াম ক্লোরাইডের দ্রবণীয়তা সোডিয়াম ক্লোরাইডের চেয়ে 30 °C তাপমাত্রায় বেশি এবং 10 °C তাপমাত্রায় কম। এই তাপমাত্রা-নির্ভর দ্রবণীয়তার পার্থক্য এবং সাধারণ-আয়ন প্রভাবের কারণে, অ্যামোনিয়াম ক্লোরাইড একটি সোডিয়াম ক্লোরাইড দ্রবণে অবক্ষয়িত হয়।
হাউ প্রক্রিয়ার চীনা নাম, লিয়ানহে ঝিজিয়ান ফা (联合制碱法), মানে "কাপলড ম্যানুফ্যাকচারিং ক্ষার পদ্ধতি": হাউ-এর প্রক্রিয়াটি হ্যাবার প্রক্রিয়ার সাথে মিলিত হয় এবং ক্যালসিয়াম ক্লোরাইডের উৎপাদন বাদ দিয়ে উন্নত পরমাণু অর্থনীতির প্রস্তাব দেয়, যেহেতু অ্যামোনিয়ার আর প্রয়োজন নেই। regenerated করা উপজাত অ্যামোনিয়াম ক্লোরাইড সার হিসাবে বিক্রি করা যেতে পারে।
তথ্যসূত্র
সম্পাদনা- ↑ ক খ গ ঘ Harper, J. P. (১৯৩৬)। Antipov, Evgeny; Bismayer, Ulrich; Huppertz, Hubert; Petrícek, Václav; Pöttgen, Rainer; Schmahl, Wolfgang; Tiekink, E. R. T.; Zou, Xiaodong, সম্পাদকগণ। "Crystal Structure of Sodium Carbonate Monohydrate, Na2CO3. H2O"। Zeitschrift für Kristallographie - Crystalline Materials। 95 (1): 266–273। আইএসএসএন 2196-7105। ডিওআই:10.1524/zkri.1936.95.1.266। সংগ্রহের তারিখ ২০১৪-০৭-২৫।
- ↑ ক খ গ ঘ ঙ চ ছ Lide, David R. (২০০৯)। Handbook of Chemistry and Physics (90 সংস্করণ)। Boca Raton, Florida: CRC Press। আইএসবিএন 978-1-4200-9084-0। অজানা প্যারামিটার
|1=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ ক খ Seidell, Atherton; Linke, William F. (১৯১৯)। Solubilities of Inorganic and Organic Compounds (2nd সংস্করণ)। New York: D. Van Nostrand Company। পৃষ্ঠা 633।
- ↑ ক খ Comey, Arthur Messinger; Hahn, Dorothy A. (ফেব্রুয়ারি ১৯২১)। A Dictionary of Chemical Solubilities: Inorganic (2nd সংস্করণ)। New York: The MacMillan Company। পৃষ্ঠা 208–209।
- ↑ ক খ গ ঘ Anatolievich, Kiper Ruslan। "sodium carbonate"। chemister.ru। সংগ্রহের তারিখ ২০১৪-০৭-২৫।
- ↑ "Sodium carbonate"। www.chemicalbook.com। সংগ্রহের তারিখ ২৫ জুন ২০২১।
- ↑ ক খ Pradyot, Patnaik (২০০৩)। Handbook of Inorganic Chemicals। McGraw-Hill। পৃষ্ঠা 861। আইএসবিএন 978-0-07-049439-8।
- ↑ ক খ গ ঘ Dusek, Michal; Chapuis, Gervais; Meyer, Mathias; Petricek, Vaclav (২০০৩)। "Sodium carbonate revisited" (পিডিএফ)। Acta Crystallographica Section B। 59 (3): 337–352। আইএসএসএন 0108-7681। ডিওআই:10.1107/S0108768103009017। পিএমআইডি 12761404। সংগ্রহের তারিখ ২০১৪-০৭-২৫।
- ↑ ক খ গ Betzel, C.; Saenger, W.; Loewus, D. (১৯৮২)। "Sodium Carbonate Heptahydrate"। Acta Crystallographica Section B। 38 (11): 2802–2804। ডিওআই:10.1107/S0567740882009996।
- ↑ ক খ গ Sigma-Aldrich Co. Retrieved on 2014-05-06.
- ↑ Chambers, Michael। "ChemIDplus - 497-19-8 - CDBYLPFSWZWCQE-UHFFFAOYSA-L - Sodium carbonate [NF] - Similar structures search, synonyms, formulas, resource links, and other chemical information"।
- ↑ "Material Safety Data Sheet – Sodium Carbonate, Anhydrous" (পিডিএফ)। conservationsupportsystems.com। ConservationSupportSystems। সংগ্রহের তারিখ ২০১৪-০৭-২৫।
- ↑ ক খ https://www.ccmr.cornell.edu/wp-content/uploads/sites/2/2015/11/Water-Hardness-Reading.pdf [অনাবৃত ইউআরএল পিডিএফ]
- ↑ Ullmann's Encyclopedia of Industrial Chemistry।
আরও পড়ুন
সম্পাদনা- Eggeman, T. (২০১১)। "Sodium Carbonate"। Kirk-Othmer Encyclopedia of Chemical Technology। আইএসবিএন 978-0471238966। ডিওআই:10.1002/0471238961.1915040918012108.a01.pub3।
- Thieme, C. (২০০০)। "Sodium Carbonates"। Ullmann's Encyclopedia of Industrial Chemistry। আইএসবিএন 978-3527306732। ডিওআই:10.1002/14356007.a24_299।
