নাইট্রাস অ্যাসিড
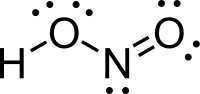
নাইট্রাস এসিড (আণবিক সংকেত HNO2) একধরণের মনোপ্রোটিক অম্ল, যা কেবল দ্রবণ, গ্যাস অথবা নাইট্রাইট (NO−
2) লবণ হিসেবে পাওয়া যায়।[১] অ্যামিন থেকে ডায়াজোনিয়াম লবণ প্রস্তুত করতে নাইট্রাস এসিড ব্যবহৃত হয়।
| |
| নামসমূহ | |
|---|---|
| পছন্দসই ইউপ্যাক নাম
নাইট্রাস এসিড | |
| পদ্ধতিগত ইউপ্যাক নাম
হাইড্রোক্সিডোঅডোক্সিডোনাইট্রোজেন | |
| শনাক্তকারী | |
ত্রিমাত্রিক মডেল (জেমল)
|
|
| থ্রিডিমেট | |
| সিএইচইবিআই | |
| সিএইচইএমবিএল | |
| কেমস্পাইডার | |
| ইসিএইচএ ইনফোকার্ড | ১০০.০২৯.০৫৭ |
| ইসি-নম্বর |
|
| মেলিন রেফারেন্স | ৯৮৩ |
| কেইজিজি | |
| এমইএসএইচ | Nitrous+acid |
পাবকেম CID
|
|
| ইউএনআইআই | |
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|
| |
| |
| বৈশিষ্ট্য | |
| HNO2 | |
| আণবিক ভর | ৪৭.০১৩ গ্রাম/মোল |
| বর্ণ | ফ্যাকাশে নীল দ্রবণ |
| ঘনত্ব | আনু. ১ গ্রা/মিলি |
| গলনাঙ্ক | কেবল দ্রবণ বা গ্যাস হিসাবে পরিচিত |
| অম্লতা (pKa) | ৩.১৫ |
| অনুবন্ধী ক্ষারক | নাইট্রাইট |
| ঝুঁকি প্রবণতা | |
| এনএফপিএ ৭০৪ | |
| ফ্ল্যাশ পয়েন্ট | অদাহ্য |
| সম্পর্কিত যৌগ | |
অন্যান্য অ্যানায়নসমূহ
|
নাইট্রিক এসিড |
অন্যান্য ক্যাটায়নসমূহ
|
সোডিয়াম নাইট্রেট পটাশিয়াম নাইট্রেট অ্যামোনিয়াম নাইট্রেট |
সম্পর্কিত যৌগ
|
ডাইনাইট্রোজেন ট্রাইঅক্সাইড |
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |
| তথ্যছক তথ্যসূত্র | |
গঠন
সম্পাদনাগ্যাসীয় অবস্থায় সমতলীয় নাইট্রাস এসিড syn এবং anti উভয় বিন্যাসযুক্ত হতে পারে। কক্ষ তাপমাত্রায় anti গঠন প্রাধান্য পায় এবং অবলোহিত বর্ণালীবীক্ষণ অনুযায়ী এটি প্রায় ২.৩ কিলোজুল/মোল অধিক স্থিতিশীল।[১]
-
anti গঠনের মাত্রা (মাইক্রোওয়েভ বর্ণালী থেকে)
-
anti গঠনের মডেল
-
syn গঠন
প্রস্তুতি
সম্পাদনাসাধারণত খনিজ এসিড দ্বারা সোডিয়াম নাইট্রাইটের জলীয় দ্রবণের অম্লীকরণের মাধ্যমে নাইট্রাস এসিড উৎপন্ন করা হয়। অম্লীকরণ সাধারণত বরফবিন্দুর তাপমাত্রায় পরিচালিত হয় এবং HNO2 সিটুতে শোষণ করে নেওয়া হয়।[২][৩] মুক্ত নাইট্রাস এসিড অস্থিতিশীল এবং তা দ্রুত পচে যায়।
নিম্নোক্ত সমীকরণ অনুযায়ী পানিতে ডাইনাইট্রোজেন ট্রাইঅক্সাইড দ্রবীভূত করেও নাইট্রাস এসিড তৈরি করা যায়
- N2O3 + H2O → 2 HNO2
বিক্রিয়া
সম্পাদনাপচন
সম্পাদনাবায়বীয় নাইট্রাস এসিড, যা খুব কমই পাওয়া যায়, পচে নাইট্রোজেন ডাই-অক্সাইড, নাইট্রিক অক্সাইড এবং পানিতে পরিণত হয়
- 2 HNO2 → NO2 + NO + H2O
নাইট্রোজেন ডাই-অক্সাইড জলীয় দ্রবণে নাইট্রিক এসিড এবং নাইট্রাস এসিডে পরিণত হয়:[৪]
- 2 NO2 + H2O → HNO3 + HNO2
উষ্ণ বা ঘন দ্রবণে সামগ্রিক বিক্রিয়া নাইট্রিক এসিড, পানি এবং নাইট্রিক অক্সাইড উৎপন্ন করে
- 3 HNO2 → HNO3 + 2 NO + H2O
নাইট্রিক অক্সাইডকে পরবর্তীতে বায়ুর মাধ্যমে জারিত করে নাইট্রিক অ্যাসিডে রূপান্তর করা যায়:
- 2 HNO2 + O2 → 2 HNO3
বিয়োজন
সম্পাদনাI− এবং Fe2+ আয়নের সাথে বিক্রিয়ায় NO উৎপন্ন হয়:[৫]
- 2 KNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 KNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + K2SO4
Sn2+ আয়নের সাথে বিক্রিয়ায় N2O উৎপন্ন হয়:
- 2 KNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 3 H2O + 2 KCl
SO2 গ্যাসের সাথে বিক্রিয়ায় NH2OH উৎপন্ন হয়:
- 2 KNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
ক্ষার দ্রবণের মধ্যে Zn এর সাথে বিক্রিয়ায় NH3 উৎপন্ন হয়:
- 5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn(OH)2
N
2H+
5 এর সাথে বিক্রিয়ায় HN3, এবং পরে, N2 গ্যাস উৎপন্ন হয়:
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
নাইট্রাস অ্যাসিড কর্তৃক জারণের ক্ষেত্রে তাপগতীয় নিয়ন্ত্রণের চেয়ে অধিক গতিশীল নিয়ন্ত্রণ রয়েছে। এটির সর্বোত্তম উদাহরণ এই যে, লঘু নাইট্রাস অ্যাসিড I− কে জারিত করে I2 করতে সক্ষম, তবে লঘু নাইট্রিক এসিড তা করতে পারে না।
- I2 + 2 e− ⇌ 2 I− Eo = +0.54 V
- NO−
3 + 3 H+ + 2 e− ⇌ HNO2 + H2O Eo = +0.93 V
- HNO2 + H+ + e− ⇌ NO + H2O Eo = +0.98 V
এই বিক্রিয়াগুলোতে Eo
cell এর মান প্রায় একই রকম হতে পারে, তবে নাইট্রিক এসিড অনেক শক্তিশালী জারক। যেহেতু লঘু নাইট্রাস এসিড আয়োডাইডকে আয়োডিনে জারিত করতে পারে, সেই ভিত্তিতে এটি অনুমান করা যেতে পারে যে নাইট্রাস আরও শক্তিশালী জারক নাইট্রিক এসিডের চেয়ে দ্রুততর।[৫]
তথ্যসূত্র
সম্পাদনা- ↑ ক খ Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। আইএসবিএন 0080379419। p. 462.
- ↑ Y. Petit, M. Larchevêque (১৯৯৮)। "Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate"। Org. Synth.। 75: 37। ডিওআই:10.15227/orgsyn.075.0037।
- ↑ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser (২০০২)। "Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine"। Org. Synth.। 78: 51। ডিওআই:10.15227/orgsyn.078.0051।
- ↑ Kameoka, Yohji; Pigford, Robert (ফেব্রুয়ারি ১৯৭৭)। "Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous"। Ind. Eng. Chem. Fundamen.। 16 (1): 163–169। ডিওআই:10.1021/i160061a031।
- ↑ ক খ Catherine E. Housecroft; Alan G. Sharpe (২০০৮)। "Chapter 15: The group 15 elements"। Inorganic Chemistry, 3rd Edition। Pearson। পৃষ্ঠা 449। আইএসবিএন 978-0-13-175553-6।
