অণু
অণু হচ্ছে কোনো পদার্থের ক্ষুদ্রতম একক, যাতে ঐ পদার্থের সকল গুণাগুণ বিদ্যমান থাকে। অণুর গঠনে রাসায়নিক বন্ধনে আবদ্ধ দুই বা ততোধিক তড়িৎ-নিরপেক্ষ পরমাণু থাকে।[১][২][৩][৪][৫][৬] এতে বৈদ্যুতিক আধানের অভাব থাকায় তাদেরকে খুব সহজে আয়ন থেকে পৃথকভাবে শনাক্ত করা যায়। আয়নে বৈদ্যুতিক আধান থাকে কিন্তু অণু আধান-নিরপেক্ষ। পদার্থ বিজ্ঞান ও রসায়ন বিজ্ঞানে অণু বহুল আলোচিত একটি শব্দ। বায়ব (gas) গতি তত্ত্বে এর পরিমাণ বোঝাতে অণু শব্দ ব্যবহৃত হয় (যেমন- দুই অণু অক্সিজেন)। এই গতিসুত্রানুসারে নিষ্ক্রিয় বায়ব পরমাণুকে অণু হিসেবে বিবেচনা করা যায়। কেননা নিষ্ক্রিয় বায়বের পরমাণু সাধারণ অবস্থায় অন্য বায়বের মত পরস্পর যুক্ত হয়ে অণু গঠন করে না।[৭]

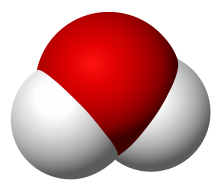
দুই বা ততোধিক পরমাণু বা অণু যুক্ত হয়ে অণু গঠন করে। যেমন: অক্সিজেনের অণু: O2, হাইড্রোজেনের অণু H2, জলের অণু: H2O অণুতে পরমাণুগুলো পরস্পর আয়নিক অথবা সমযোজী বন্ধনের মাধ্যমে যুক্ত থাকে।[৮]
হাইড্রোজেন বন্ড বা আয়নিক বন্ডের মতো অ-সমযোজী ইন্টারঅ্যাকশন দ্বারা সংযুক্ত পরমাণু এবং কমপ্লেক্সগুলো সাধারণত একক অণু হিসাবে বিবেচিত হয় না।[৯]
পদার্থের উপাদান হিসাবে অণুগুলো সাধারণ। এগুলো বেশিরভাগ মহাসাগর এবং বায়ুমণ্ডলও তৈরি করে। বেশিরভাগ জৈব পদার্থ হল অণু। জীবনসৃষ্টিকারী পদার্থগুলো, যেমন- প্রোটিন, অ্যামিনো অ্যাসিডগুলো অণু দিয়ে তৈরি। নিউক্লিক অ্যাসিড (ডিএনএ এবং আরএনএ), সুগার, কার্বোহাইড্রেট, চর্বি এবং ভিটামিন। পুষ্টিকর খনিজগুলো সাধারণত অণু নয়, যেমন: আয়রন সালফেট।



তবে, পৃথিবীতে পরিচিত বেশিরভাগ কঠিন পদার্থ অণু দ্বারা তৈরি নয়। এর মধ্যে রয়েছে এমন সমস্ত খনিজ যা পৃথিবীর পদার্থ, মাটি, ময়লা, বালু, কাদামাটি, নুড়ি, পাথর, পাথর, বেডরক, গলিত অভ্যন্তর এবং পৃথিবীর মূলকে অন্তর্ভুক্ত করে। এগুলির মধ্যে অনেকগুলি রাসায়নিক বন্ধন রয়েছে তবে এটি শনাক্তযোগ্য অণু দ্বারা তৈরি নয়।
কোনও সাধারণ অণু লবণের জন্য বা সমযোজী স্ফটিকগুলির জন্য সংজ্ঞায়িত করা যায় না, যদিও এগুলি প্রায়শই পুনরাবৃত্তি ইউনিটের কোষগুলির দ্বারা গঠিত হয় যা কোনও প্লেনে বিস্তৃত হয়, যেমন। গ্রাফিন বা ত্রি-মাত্রিক উদাঃ হীরা, কোয়ার্টজ, সোডিয়াম ক্লোরাইড। পুনরাবৃত্ত ইউনিট-সেলুলার-কাঠামোর থিমটি বেশিরভাগ ধাতুগুলির জন্যও ধারণ করে যা ধাতব বন্ধনের সাথে ঘনীভূত পর্যায়গুলি রয়েছে। সুতরাং শক্ত ধাতুগুলি অণু দ্বারা তৈরি হয় না।কাচগুলোয়, যা কঠিন এবং যা একটি বিতর্কিত বিশৃঙ্খলাবদ্ধ অবস্থার মধ্যে বিদ্যমান, রাসায়নিকগুলি রাসায়নিক বন্ড দ্বারা একত্রিত হয়, একটি নির্দিষ্ট অণুর উপস্থিতি না থাকার পরও, না লবণ চিহ্নিত করে এমন নিয়মিত পুনরাবৃত্তি একক-সেলুলার-কাঠামো ,সমযোজী স্ফটিকসমূহ এবং ধাতুসমূহ।
আণবিক বিজ্ঞান
সম্পাদনা[রসায়ন] বা [পদার্থবিজ্ঞান]এর উপর ফোকাস করা হচ্ছে কিনা তার উপর নির্ভর করে অণু বিজ্ঞানকে [আণবিক রসায়ন] বা [আণবিক পদার্থবিজ্ঞান] বলা হয়। আণবিক রসায়ন অণুগুলোর মধ্যে মিথস্ক্রিয়া নিয়ন্ত্রণকারী আইনগুলির সাথে সম্পর্কিত যা রাসায়নিক বন্ধনগুলি গঠন এবং ভাঙ্গন (যখন আণবিক পদার্থবিজ্ঞান তাদের কাঠামো এবং বৈশিষ্ট্যগুলো নিয়ন্ত্রণ করে) এমন আইনগুলি নিয়ে কাজ করে। আণবিক বিজ্ঞানে, একটি অণুতে দুটি বা ততোধিক পরমাণুর সমন্বয়ে একটি স্থিতিশীল ব্যবস্থা থাকে। পলিটমিক আয়নগুলি কখনও কখনও বৈদ্যুতিকভাবে চার্জযুক্ত অণু হিসাবে কার্যকরী। অস্থিতিশীল অণু শব্দটি খুব প্রতিক্রিয়াশীল প্রজাতিগুলির জন্য ব্যবহৃত হয়, যেমন,[অনুরণন],[আণবিক নিউক্লিয়াস],[রেডিকাল], আণবিক [আয়ন], রাইডবার্গ অণু, ট্রানজিশন স্টেটস, [ভ্যানডার ওয়ালস বন্ধন], কমপ্লেক্স বা সংঘর্ষের পরমাণুর ব্যবস্থার জন্য [বোস-আইনস্টাইন ঘনীভবন]। Tamim brasil supprter
ইতিহাস এবং ব্যুৎপত্তি
সম্পাদনামেরিয়াম-ওয়েবস্টার এবং অনলাইন এটিমোলজির অভিধান অনুসারে, "অণু" শব্দটি লাতিন "মোলস" বা ভরয়ের ক্ষুদ্র একক থেকে উদ্ভূত হয়েছে।
অণু (১৭৯৪) - "অত্যন্ত মিনিটের কণা", ফ্রেঞ্চ মোলাকুলি (১৬৭৮) থেকে, নিউ লাতিন অণু থেকে, লাতিন moles থেকে যার অর্থ ক্ষুদ্রতর। প্রথমে একটি অস্পষ্ট শব্দের প্রচলন (১৮ শতকের শেষদিকে কেবল লাতিন আকারে ব্যবহৃত হয়েছিল) ডেসকার্টসের দর্শনে শনাক্ত করা যায়।[১৩][১৪]
অণুর সংজ্ঞাটি যখন অণুগুলির কাঠামোগত জ্ঞান বৃদ্ধি পেয়েছে তখন বিকশিত হয়েছে। পূর্বের সংজ্ঞাগুলি কম সুনির্দিষ্ট ছিল,বিশুদ্ধ রাসায়নিক পদার্থের ক্ষুদ্রতম কণা হিসাবে অণুকে সংজ্ঞায়িত করা হলেও তাদের গঠন এবং রাসায়নিক বৈশিষ্ট্য বজায় রেখেছে।।[১৫] এই সংজ্ঞাটি প্রায়শই ভেস্তে যায় যেহেতু সাধারণ সংজ্ঞার অনেকগুলি উপাদান যেমন শিলা, লবণ এবং ধাতুগুলি রাসায়নিকভাবে বাঁধা পরমাণু বা আয়নগুলির বৃহত স্ফটিক নেটওয়ার্কগুলির দ্বারা গঠিত তবে এটি পৃথক অণু দ্বারা তৈরি হয় না।
বন্ধন
সম্পাদনাঅণুগুলি সমবায় বন্ধন বা আয়নিক বন্ধন দ্বারা একত্রে গঠিত হয়। বেশ কয়েক ধরনের অধাতব উপাদান পরিবেশে কেবল অণু হিসাবে বিদ্যমান। উদাহরণস্বরূপ, হাইড্রোজেন কেবল হাইড্রোজেন অণু হিসাবে বিদ্যমান। একটি যৌগের একটি অণু দুটি বা ততোধিক উপাদানগুলির দ্বারা তৈরি হয়। [১৬] একটি একক উপাদানের দুই বা ততোধিক পরমাণু দিয়ে একটি সমপারমানবিক অণু তৈরি করা হয়।
কিছু লোকেরা যখন বলেন যে ধাতব স্ফটিককে ধাতব বন্ধন দ্বারা একত্রে রাখা একক দৈত্য অণু হিসাবে বিবেচনা করা যেতে পারে,[১৭] অন্যরা উল্লেখ করেছেন যে এটি ধাতব অণুগুলির চেয়ে খুব আলাদাভাবে কাজ করে। [১৮]
সমযোজী
সম্পাদনাসমযোজী বন্ধন এমন এক ধরনের রাসায়নিক বন্ধন যেখানে পরমাণুসমূহ তাদের নিজেদের মধ্যে ইলেকট্রন শেয়ারের মাধ্যমে আবদ্ধ থাকে। এই ইলেক্ট্রন জোড়াগুলিকে অংশীদারি জোড় বা বন্ধন যুগল বলে অভিহিত করা হয় এবং পরমাণুর মধ্যে আকর্ষণ ও বিকর্ষণকারী শক্তির স্থিতিশীল ভারসাম্য( যখন তারা ইলেক্ট্রন ভাগ করে) হলে, তখন তাকে সমবায় বন্ধন বলে।[১৯]
আরো জানতেঃসমযোজী বন্ধন
আয়নিক
সম্পাদনাআয়নিক বন্ধন এক ধরনের রাসায়নিক বন্ধন যা বিপরীত চার্জ যুক্ত আয়নগুলির মধ্যে স্থির বৈদ্যুতিক আকর্ষণ যুক্ত করে এবং এটি আয়নিক যৌগগুলিতে সংঘটিত প্রাথমিক মিথস্ক্রিয়া। আয়নগুলি এমন একধরনের পরমাণু যা এক বা একাধিক ইলেকট্রন হারায় (ক্যাটায়ন) এবং পরমাণুগুলি যা এক বা একাধিক ইলেকট্রন অর্জন করে (অ্যানায়ন)।[২০] এই ইলেকট্রন স্থানান্তরকে সমযোজীর বিপরীতে electrovalance বলে অভিহিত করা হয়। সহজতম ক্ষেত্রে, ক্যাটায়ন টি একটি ধাতব পরমাণু এবং অ্যানায়ন একটি অধাতব পরমাণু, তবে এই আয়নগুলি আরও জটিল প্রকৃতির হতে পারে, যেমন। NH4 + বা SO42− এর মতো অণু আয়নগুলি।
সাধারণ তাপমাত্রা এবং চাপগুলিতে, আয়নিক বন্ধন বেশিরভাগ সময় কঠিন (বা মাঝে মাঝে তরল) অণু তৈরি করে তবে বাষ্পীকরণ / পরমানন্দ এ জাতীয় উপকরণগুলি ছোটো আলাদা পৃথক অণু তৈরি করে যেখানে ইলেক্ট্রনগুলি সমঝোতার পরিবর্তে বন্ডগুলি আয়নিক হিসাবে বিবেচনা করার জন্য যথেষ্ট পরিমাণে স্থানান্তরিত হয়।[২১]
আণবিক আকার
সম্পাদনাঅণুর আকৃতি
সম্পাদনাঅধিকাংশ অণু অতিক্ষুদ্র। খালি চোখে তাদের দেখা যায় না। কিছু ব্যতিক্রম অবশ্য আছে। যেমন পলিমার্। অণুর আকৃতি কয়েক এংস্ট্রম থেকে কয়েক ডজন এংস্ট্রম হতে পারে। বড়ো অণুকে রসায়নের ভাষায় বলা হয় ম্যাক্রো অণু বা সুপার অণু।
ব্যাসার্ধ
সম্পাদনাদ্রবনের কার্যকরী আণবিক ব্যাসার্ধই হচ্ছে একটি অণুর সাইজ বা আকৃতি।[২২][২৩]
সবথেকে ক্ষুদ্র অনু
সম্পাদনাদ্বি আণবিক হাইড্রোজেন হচ্ছে সব থেকে ক্ষুদ্রাকৃতির অণু (H2), এর বন্ধন দূরত্ব ০.৭৪ Å.[২৪]
সবথেকে বড়ো অনু
সম্পাদনামেসোপোরাস সিলিকার ব্যাস ১০০০ এংস্ট্রম। ( 1000 Å) (100 nm)[২৫]
আণবিক সূত্র
সম্পাদনারাসায়নিক প্রকার সূত্র
সম্পাদনাঅণুর রাসায়নিক সূত্রে রাসায়নিক উপাদানগুলির চিহ্নগুলির একটি লাইন, সংখ্যা এবং কখনও কখনও অন্যান্য চিহ্নগুলি যেমন বন্ধনী, ড্যাশ, বন্ধনী এবং প্লাস (+) এবং বিয়োগ (-) চিহ্ন ব্যবহৃত হয়। এগুলি চিহ্নগুলির একটি টাইপোগ্রাফিক লাইনের মধ্যে সীমাবদ্ধ, এতে সাবস্ক্রিপ্ট এবং সুপারস্প্রিপ্ট অন্তর্ভুক্ত থাকতে পারে। একটি যৌগের অভিজ্ঞতামূলক সূত্রটি একটি খুব সাধারণ ধরনের রাসায়নিক সূত্র।এটি গঠিত রাসায়নিক উপাদানগুলির মধ্যে সহজতম পূর্ণসংখ্যার অনুপাত।[২৬] উদাহরণস্বরূপ, জল সবসময় অক্সিজেন পরমাণুর সাথে হাইড্রোজেনের 2: 1 অনুপাতের সমন্বয়ে গঠিত এবং ইথানল (ইথাইল অ্যালকোহল) সর্বদা 2: 6: 1 অনুপাতের কার্বন, হাইড্রোজেন এবং অক্সিজেন দ্বারা গঠিত। যাইহোক, এটি অণুর ধরনের স্বতন্ত্রভাবে নির্ধারণ করে না - উদাহরণস্বরূপ, ডাইমথাইল ইথারের ইথানলের মতো অনুপাত রয়েছে। বিভিন্ন ব্যবস্থায় একই পরমাণুযুক্ত অণুগুলিকে আইসোমারস বলা হয়। এছাড়াও কার্বোহাইড্রেটগুলির উদাহরণস্বরূপ, একই অনুপাত রয়েছে (কার্বন: হাইড্রোজেন: অক্সিজেন = 1: 2: 1) (এবং এইভাবে একই অনুশীলন সূত্র) তবে অণুর বিভিন্ন মোট সংখ্যা পরমাণু। আণবিক সূত্র পরমাণুর সঠিক সংখ্যার প্রতিফলন ঘটায় যা অণু গঠন করে এবং বিভিন্ন ধরনের অণুকে বৈশিষ্ট্যায়িত করে। তবে আলাদা আলাদা অণুতে থাকার সময় বিভিন্ন আইসোমার এর একই পারমাণবিক গঠন থাকতে পারে।
অনুশীলন সূত্রটি প্রায়শই আণবিক সূত্রের মতো তবে সর্বদা নয়। উদাহরণস্বরূপ, অণু অ্যাসিটিলিনে আণবিক সূত্র সি 2 এইচ 2 থাকে তবে উপাদানগুলির সহজতম পূর্ণসংখ্যার অনুপাত সিএইচ হয়।
আণবিক ভর রাসায়নিক সূত্র থেকে গণনা করা যায় এবং একটি নিরপেক্ষ কার্বন -12 (12 সি আইসোটোপ) পরমাণুর ভর 1/1 এর সমানুগতিক পারমাণবিক ভর ইউনিটগুলিতে প্রকাশ করা হয়। নেটওয়ার্ক সলিউডের জন্য, সূত্র ইউনিট শব্দটি স্টোচিওমেট্রিক গণনায় ব্যবহৃত হয়।
কাঠামোগত সূত্র
সম্পাদনাএকটি জটিল ত্রি-মাত্রিক কাঠামোযুক্ত অণুয, বিশেষত চারটি পৃথক পদার্থের সাথে জড়িত পরমাণুর সাথে জড়িত, একটি সাধারণ আণবিক সূত্র বা এমনকি আধা-কাঠামোগত রাসায়নিক সূত্র অণু সম্পূর্ণরূপে নির্দিষ্ট করার জন্য যথেষ্ট নাও হতে পারে। এই ক্ষেত্রে, কাঠামোগত সূত্র নামে পরিচিত গ্রাফিক্যাল ধরনের সূত্রের প্রয়োজন হতে পারে। কাঠামোগত সূত্রগুলি পরিবর্তে এক-মাত্রিক রাসায়নিক নামের সাথে উপস্থাপিত হতে পারে তবে এই জাতীয় নামকরণের জন্য অনেকগুলি শব্দ এবং পদ প্রয়োজন যা রাসায়নিক সূত্রের অংশ নয়।
আণবিক জ্যামিতি
সম্পাদনাঅণুগুলিতে স্থির ভারসাম্য জ্যামিতি — বন্ধনের দৈর্ঘ্য এবং কোণগুলি যা তারা ক্রমাগত কম্পন এবং ঘূর্ণন গতির মাধ্যমে দোলায়। একটি খাঁটি পদার্থ একই গড় জ্যামিতিক কাঠামোযুক্ত অণু দ্বারা গঠিত। রাসায়নিক সূত্র এবং একটি অণুর গঠন দুটি গুরুত্বপূর্ণ কারণ এর বৈশিষ্ট্যগুলি যা নির্ধারণ করে,তা বিশেষত এর প্রতিক্রিয়া। আইসোমাররা একটি রাসায়নিক সূত্র ভাগ করে তবে তাদের কাঠামোর কারণে সাধারণত খুব আলাদা বৈশিষ্ট্য থাকে। স্টিরিওসোমারস, একটি বিশেষ ধরনের আইসোমার,এর সাথে খুব একই রকমের ফিজিকো-রাসায়নিক বৈশিষ্ট্য এবং একই সাথে বিভিন্ন জৈব রাসায়নিক পদার্থ থাকতে পারে।
আণবিক বর্ণালী
সম্পাদনাআণবিক স্পেকট্রোস্কোপি জানা শক্তির (বা ফ্রিকোয়েন্সি, প্ল্যাঙ্কের সূত্র অনুসারে) অনুসন্ধানের সংকেতগুলির সাথে মিথস্ক্রিয়া করে অণুগুলির প্রতিক্রিয়া (বর্ণালী) নিয়ে কাজ করে। অণুতে শক্তির মাত্রা পরিমাণ রয়েছে যা শোষণ বা নির্গমনের মাধ্যমে অণুর শক্তি বিনিময় শনাক্ত করে বিশ্লেষণ করা যেতে পারে। [২৯] স্পেকট্রোস্কপি সাধারণত বিচ্ছিন্নতা অধ্যয়নের উল্লেখ করে না যেখানে নিউট্রন, ইলেক্ট্রন বা উচ্চ শক্তির এক্স-রে এর মতো কণা অণুগুলির নিয়মিত বিন্যাসের সাথে (যেমন স্ফটিকের মতো) মিথঃস্ক্রিয়া করে।
মাইক্রোওয়েভ স্পেকট্রোস্কোপি সাধারণত অণুগুলির ঘূর্ণনের পরিবর্তনগুলি পরিমাপ করে এবং বাইরের স্থানের অণু শনাক্ত করতে ব্যবহার করা যেতে পারে। ইনফ্রারেড স্পেকট্রোস্কোপি স্ট্রেচিং, নমন বা মোচড়ানোর গতি সহ অণুগুলির কম্পনকে পরিমাপ করে। এটি সাধারণত অণুগুলিতে ধরনের বন্ড বা কার্যকরী গোষ্ঠীগুলি শনাক্ত করতে ব্যবহৃত হয়। ইলেকট্রনগুলির বিন্যাসের পরিবর্তন অতিবেগুনীতে দৃশ্যমান বা নিকটে ইনফ্রারেড আলোতে শোষণ বা নির্গমন রেখার ফল দেয় এবং ফলাফল রঙ ধারণ করে। পারমাণবিক বর্ণালোক অনুরণন অণুতে নির্দিষ্ট নিউক্লিয়াসের পরিবেশ পরিমাপ করে এবং অণুতে বিভিন্ন পদার্থে পরমাণুর সংখ্যা চিহ্নিত করতে ব্যবহার করা যেতে পারে।
তাত্ত্বিক দিক
সম্পাদনাআণবিক পদার্থবিজ্ঞান এবং তাত্ত্বিক রসায়ন দ্বারা অণু অধ্যয়ন মূলত কোয়ান্টাম মেকানিক্সের উপর ভিত্তি করে এবং রাসায়নিক বন্ধনের বোঝার জন্য প্রয়োজনীয়। অণুগুলির মধ্যে সর্বাধিক সহজ হাইড্রোজেন অণু-আয়ন, H2+ এবং সমস্ত রাসায়নিক বন্ধনের মধ্যে সর্বাধিক সহজ হ'ল এক-ইলেকট্রনের বন্ধন। H2+ দুটি ইতিবাচক চার্জযুক্ত প্রোটন এবং একটি নেতিবাচক চার্জড ইলেক্ট্রন দ্বারা গঠিত, যার অর্থ এই যে ইলেক্ট্রন বিকর্ষণ এর অভাবে সিস্টেমের জন্য শ্রোডিঞ্জার এর সমীকরণটি আরও সহজে সমাধান করা যায়। দ্রুত ডিজিটাল কম্পিউটারগুলির বিকাশের সাথে সাথে আরও জটিল অণুগুলির জন্য আনুমানিক সমাধানগুলি সম্ভব হয়েছিল এবং এটি গণনীয় রসায়নের অন্যতম প্রধান বিষয়।
অণু হিসাবে বিবেচনা করার জন্য পরমাণুর বিন্যাস যথেষ্ট পরিমাণে স্থিতিশীল কিনা তা কঠোরভাবে সংজ্ঞায়নের চেষ্টা করার সময়, আইইউপিএসি পরামর্শ দেয় যে It must correspond to a depression on the potential energy surface that is deep enough to confine at least one vibrational state। [৩০] এই সংজ্ঞাটি পরমাণুর মধ্যে মিথস্ক্রিয়া প্রকৃতির উপর নির্ভর করে না, তবে কেবল মিথস্ক্রিয়া শক্তির উপর। প্রকৃতপক্ষে, এটি দুর্বলভাবে আবদ্ধ প্রজাতিগুলিকে অন্তর্ভুক্ত করেছে যা ঐতিহ্যগতভাবে হিলিয়াম ডাইমার, He2 এর মতো অণু হিসাবে বিবেচিত হবে না, যার একটি কম্পনযুক্ত বন্ড স্টেট রয়েছে [৩০] এবং এটি এতটাই আবদ্ধ যে এটি কেবল খুব কম তাপমাত্রায় পর্যবেক্ষণ করা যায়।[৩১]
অণু হিসাবে বিবেচনার জন্য পরমাণুর কোনও ব্যবস্থা যথেষ্ট স্থিতিশীল কিনা তা অন্তর্নিহিত একটি অপারেশনাল সংজ্ঞা। দার্শনিকভাবে, সবশেষে, একটি অণু একটি মৌলিক সত্তা নয় (বিপরীতে, উদাহরণস্বরূপ, একটি প্রাথমিক কণা); বরং, অণুর ধারণা হ'ল রসায়নবিদদের পৃথিবীতে পারমাণবিক-স্কেল মিথস্ক্রিয়াগুলির শক্তি সম্পর্কে একটি দরকারি বক্তব্য দেওয়ার উপায় যা আমরা দেখি।
আরও দেখুন
সম্পাদনা- রাসায়নিক পোলারিটি
- ডায়াটমিক অণু
- যৌগের তালিকা
- আন্তঃকেন্দ্র ও সংঘর্ষের অণুগুলির তালিকা
- আণবিক নকশার সফটওয়্যার
- অণু প্রকৌশল
- অণু জ্যামিতি
- হ্যামিল্টেনিয়ান অণু
- আয়নিক অণু
- আণবিক মডেলিং
- আণবিক প্রতিশ্রুতি
- আণবিক কক্ষপথ
- অ-সমযোজী বন্ধন
- [ছোট অণুগুলির পর্যায়ক্রমিক নিয়ম
- ক্ষুদ্র অণু
- অনুবলবিজ্ঞান মডেলিং তুলনার সফটওয়্যার
- ভ্যানডার ওয়ালস অণু
- বিশ্বজুড়ে অণুর পরিমাপ
তথ্যসূত্র
সম্পাদনা- ↑ International Union of Pure and Applied Chemistry (1994). "molecule". Compendium of Chemical Terminology Internet edition.
- ↑ Puling, Linus (১৯৭০)। General Chemistry। New York: Dover Publications, Inc.। আইএসবিএন 0-486-65622-5।
- ↑ Ebbin, Darrell, D. (১৯৯০)। General Chemistry, 3rd Ed.। Boston: Houghton Mifflin Co.। আইএসবিএন 0-395-43302-9।
- ↑ Brown, T.L.; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (২০০৩)। Chemistry – the Central Science, 9th Ed.। New Jersey: Prentice Hall। আইএসবিএন 0-13-066997-0।
- ↑ Chang, Raymond (১৯৯৮)। Chemistry, 6th Ed.। New York: McGraw Hill। আইএসবিএন 0-07-115221-0।
- ↑ Zumdahl, Steven S. (১৯৯৭)। Chemistry, 4th ed.। Boston: Houghton Mifflin। আইএসবিএন 0-669-41794-7।
- ↑ Chandra, Sulekh (২০০৫)। Comprehensive Inorganic Chemistry। New Age Publishers। আইএসবিএন 81-224-1512-1।
- ↑ Molecule ওয়েব্যাক মেশিনে আর্কাইভকৃত ৬ মে ২০১৫ তারিখে, Encyclopædia Britannica on-line
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩ মে ২০২০ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (২০১৫)। "Chemical structure imaging of a single molecule by atomic force microscopy at room temperature"। Nature Communications। 6: 7766। ডিওআই:10.1038/ncomms8766। পিএমআইডি 26178193। পিএমসি 4518281 । বিবকোড:2015NatCo...6.7766I।
- ↑ Dinca, L.E.; De Marchi, F.; MacLeod, J.M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D.F.; Rosei, F. (২০১৫)। "Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene"। Nanoscale। 7 (7): 3263–9। ডিওআই:10.1039/C4NR07057G। পিএমআইডি 25619890। বিবকোড:2015Nanos...7.3263D।
- ↑ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J.; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar; Jelínek, Pavel (২০১৬)। "Mapping the electrostatic force field of single molecules from high-resolution scanning probe images"। Nature Communications। 7: 11560। ডিওআই:10.1038/ncomms11560। পিএমআইডি 27230940। পিএমসি 4894979 । বিবকোড:2016NatCo...711560H।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ২২ মার্চ ২০২১ তারিখে [[[:en:Online Etymology Dictionary|Online Etymology Dictionary]] মূল]
|ইউআরএল=এর মান পরীক্ষা করুন (সাহায্য) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১। - ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ২৪ ফেব্রুয়ারি ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ https://web.archive.org/web/20141013143129/http://antoine.frostburg.edu/chem/senese/101/glossary/m.shtml#molecule
- ↑ The Hutchinson unabridged encyclopedia with atlas and weather guide. Oxford, England. OCLC https://www.worldcat.org/oclc/696918830
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি" (পিডিএফ)। ৩১ মার্চ ২০২১ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩০ অক্টোবর ২০২০ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ২ নভেম্বর ২০১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩১ মার্চ ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩১ মার্চ ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ Chang RL, Deen WM, Robertson CR, Brenner BM. (১৯৭৫)। "Permselectivity of the glomerular capillary wall: III. Restricted transport of polyanions"। Kidney Int.। 8 (4): 212–218। ডিওআই:10.1038/ki.1975.104। পিএমআইডি 1202253।
- ↑ Chang RL, Ueki IF, Troy JL, Deen WM, Robertson CR, Brenner BM. (১৯৭৫)। "Permselectivity of the glomerular capillary wall to macromolecules. II. Experimental studies in rats using neutral dextran"। Biophys J.। 15 (9): 887–906। ডিওআই:10.1016/S0006-3495(75)85863-2। পিএমআইডি 1182263। পিএমসি 1334749 । বিবকোড:1975BpJ....15..887C।
- ↑ Roger L. DeKock; Harry B. Gray (১৯৮৯)। রাসায়নিক গঠন এবং বন্ধন। University Science Books। পৃষ্ঠা 199। আইএসবিএন 0-935702-61-X।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ২৪ জুলাই ২০২০ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৫ জুলাই ২০১৪।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ১৯ জানুয়ারি ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ Hirsch, Brandon E.; Lee, Semin; Qiao, Bo; Chen, Chun-Hsing; McDonald, Kevin P.; Tait, Steven L.; Flood, Amar H. (২০১৪)। "Anion-induced dimerization of 5-fold symmetric cyanostars in 3D crystalline solids and 2D self-assembled crystals"। Chemical Communications। 50 (69): 9827–30। ডিওআই:10.1039/C4CC03725A। পিএমআইডি 25080328।
- ↑ Zoldan, V. C.; Faccio, R; Pasa, A.A. (২০১৫)। "N and p type character of single molecule diodes"। Scientific Reports। 5: 8350। ডিওআই:10.1038/srep08350। পিএমআইডি 25666850। পিএমসি 4322354 । বিবকোড:2015NatSR...5E8350Z।
- ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩১ মার্চ ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।
- ↑ ক খ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৭ ফেব্রুয়ারি ২০২১ তারিখে [[[:en:IUPAC books#Gold Book|IUPAC books#Gold Book]] মূল]
|ইউআরএল=এর মান পরীক্ষা করুন (সাহায্য) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১। - ↑ "সংরক্ষণাগারভুক্ত অনুলিপি"। ৩১ মার্চ ২০২১ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১৯ মার্চ ২০২১।