ধাতব বন্ধন
ধাতু সমূহ যে ধরনের বন্ধনের মাধ্যমে পরস্পরের সাথে যুক্ত থাকে তা ই ধাতব বন্ধন। এই সঞ্চারণশীল ইলেকট্রন এবং ধনাত্মক চার্জ যুক্ত ধাতব আয়নের মধ্যে হয়ে থাকে। এই বিশেষ ধরনের বন্ধনের কারণেই ধাতু তাপ এবং বিদ্যুৎ পরিবহন করে। এই বন্ধন সঞ্চারণশীল ইলেকট্রন এবং ধনাত্মক চার্জ যুক্ত ধাতব আয়নের মধ্যে হয়ে থাকে। ধাতব বন্ধন ধাতুর অনেকগুলো ভৌত ধর্ম যেমন: যান্ত্রিক শক্তি, নমনীয়তা, তাপ, বৈদ্যুতিক রোধ এবং পরিবাহিতা, অস্বচ্ছতা এবং দীপ্তির জন্য দায়ী।
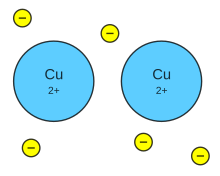
প্রতিটি ধাতব পরমাণুর ইলেকট্রন বিন্যাসে সর্বশেষ শক্তিস্তরে ১টি, ২টি কিংবা ৩টি ইলেকট্রন থাকে এবং এদের আকার একই পর্যায়ের অধাতব পরমাণুর চেয়ে বড় হওয়ায় ধাতব পরমাণুর সর্ব শেষ শক্তিস্তরের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ কম হয়। ফলে ধাতুতে পরমাণু সমূহ তার শেষ শক্তিস্তরের ইলেকট্রন গুলো ত্যাগ করে ধনাত্মক আয়নে পরিণত হয়। এই আয়নকে পারমাণবিক শাঁস (অ্যাটমিক কোর) বলা হয়। ধাতব স্ফটিকে পারমাণবিক শাঁস গুলো সুনির্দিষ্ট ত্রিমাত্রিকভাবে সজ্জিত থাকে। আর ধাতব পরমাণু কর্তৃক ত্যাগকৃত ইলেকট্রনগুলো উক্ত পারমাণবিক শাঁসের মধ্যবর্তী সথানে মুক্তভাবে ঘোরাফেরা করে। এদের সঞ্চারণশীল ইলেকট্রন বলে। এই ইলেকট্রনগুলো কোন নির্দিষ্ট পরমাণুর অধীনে না থেকে পুরো ধাতব আয়নের ইলেকট্রন হয়ে যায়।
ধাতব স্ফটিকে দুটি ধাতব আয়নের মধ্যবর্তী স্থানে যখন একটি সঞ্চারণশীল ইলেকট্রন অবস্থান করে তখন ঐ ইলেকট্রনের প্রতি উভয় ধাতব আয়নই স্থির বৈদ্যুতিক আকর্ষণে আকর্ষিত হয়। ফলে ধাতব আয়নগুলো পরস্পর থেকে বিচ্ছিন্ন হতে পারে না। এভাবেই ধাতব বন্ধন গঠিত হয়।[১][২][৩][৪]
বৈশিষ্ট্য
সম্পাদনাবিদ্যুৎ পরিবাহিতা
সম্পাদনাসকল ধাতুই বিদ্যুৎ সুপরিবাহী। ধাতুর স্ফটিকে ধাতব বন্ধনের মুক্তভাবে বিচরণশীল ইলেকট্রন গুলোর মাধ্যমে বিদ্যুৎ পরিবাহিত হয়। একটি ধাতব খন্ডের দুই প্রান্তের সাথে ব্যাটারির ধনাত্মক(+) ও ঋণাত্মক(–) প্রান্ত সংযুক্ত করলে ইলেকট্রনগুলো ঋণাত্মক প্রান্ত থেকে ধনাত্মক প্রান্তে যাওয়ার মাধ্যমে বিদ্যুৎ পরিবহন করে। এবং ধনাত্মক প্রান্ত থেকে ঋণাত্মক প্রান্তের দিকে বিদ্যুৎ প্রবাহিত হয়।
তাপ পরিবাহিতা
সম্পাদনাএক খন্ড ধাতুকে উত্তপ্ত করলে ধাতব বন্ধনের সঞ্চারণশীল ইলেকট্রনগুলো শক্তি গ্রহণ করে এবং তাদের গতিবেগ বেড়ে যায়। ফলে ইলেকট্রনগুলো অধিক তাপমাত্রার প্রান্ত থেকে কম তাপমাত্রার প্রান্তের দিকে স্থানান্তরিত হয়। এর ফলে ধাতুতে এক প্রান্ত থেকে অন্য প্রান্তে তাপের পরিবহন ঘটে।
আরো দেখুন
সম্পাদনা
| রসায়ন বিষয়ক এই নিবন্ধটি অসম্পূর্ণ। আপনি চাইলে এটিকে সম্প্রসারিত করে উইকিপিডিয়াকে সাহায্য করতে পারেন। |
তথ্যসূত্র
সম্পাদনা- ↑ রসায়ন ৯ম-১০ম শ্রেণি। জাতীয় শিক্ষাক্রম ও পাঠ্যপুস্তক বোর্ড। ২০২২। পৃষ্ঠা 104-105।
- ↑ Metal structures. chemguide.co.uk
- ↑ Chemical Bonds. chemguide.co.uk
- ↑ PHYSICS 133 Lecture Notes Spring, 2004 Marion Campus. physics.ohio-state.edu